Закон Гесса - основний закон термохіміі , Який формулюється таким чином:
- Тепловий ефект хімічної реакції , Що проводиться в ізобарно-ізотермічних або ізохорно-ізотермічних умовах, залежить тільки від виду та стану вихідних речовин і продуктів реакції і не залежить від шляху її протікання.
Іншими словами, кількість теплоти , Що виділяється або поглинається при будь-якому процесі, завжди одне і те ж, незалежно від того, чи протікає дане хімічне перетворення в одну або в кілька стадій (за умови, що температура , тиск і агрегатні стани речовин однакові). Наприклад, окислення глюкози в організмі здійснюється за дуже складного багатостадійного механізму, проте сумарний тепловий ефект всіх стадій даного процесу дорівнює теплоті згоряння глюкози.
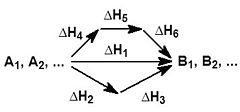

На малюнку приведено схематичне зображення деякого узагальненого хімічного процесу перетворення вихідних речовин А1, А2 ... в продукти реакції В1, В2 ..., який може бути здійснений різними шляхами в одну, дві або три стадії, кожна з яких супроводжується тепловим ефектом ΔHi. Відповідно до закону Гесса, теплові ефекти всіх цих реакцій пов'язані наступним співвідношенням:
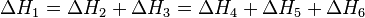
Закон відкритий російським хіміком Г. І. Гессом в 1840 г .; він є окремим випадком першого початку термодинаміки стосовно до хімічних реакцій. Практичне значення закону Гесса полягає в тому, що він дозволяє розраховувати теплові ефекти найрізноманітніших хімічних процесів; для цього зазвичай використовують ряд наслідків з нього.
Наслідки із закону Гесса [ правити | правити вихідний текст ]
- Тепловий ефект прямої реакції дорівнює за величиною і протилежний за знаком тепловому ефекту зворотної реакції ( закон Лавуазьє-Лапласа ).
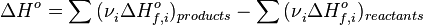
- Тепловий ефект хімічної реакції дорівнює різниці сум теплот згоряння (ΔHc) вихідних речовин і продуктів реакції, помножених на стехіометричні коефіцієнти (ν):
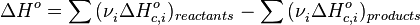
Таким чином, користуючись табличними значеннями теплот освіти або згоряння речовин, можна розрахувати теплоту реакції, не вдаючись до експерименту. Табличні величини теплот освіти і згоряння речовин зазвичай ставляться до т. Зв. стандартних умов . Для розрахунку теплоти процесу, що протікає при інших умовах, необхідно використовувати і інші закони термохімії, наприклад, закон Кірхгофа , Що описує залежність теплового ефекту реакції від температури.
- Якщо початковий і кінцевий стани хімічної реакції (реакцій) збігаються, то її (їх) тепловий ефект дорівнює нулю.


